Un equipo de investigadores del Instituto de Cáncer Tisch en Mount Sinaí ha dado un paso de gigante para resolver el gran misterio de la metástasis en la investigación del cáncer: las células cancerosas permanecen inactivas durante años después de dejar un tumor y viajar a otras partes del cuerpo, antes de despertar de nuevo. Pero, ¿dónde duerme el cáncer y cuál es el proceso que lo hace despertar de su letargo?
En un trabajo publicado este lunes en la revista Nature Cancer, un equipo en el que participa el investigador español José Javier Bravo-Cordero muestra cómo estas células tumorales permanecen “dormidas” y generan una especie de matriz extracelular o "nido" que fabrican con un tipo muy concreto de colágeno, el denominado colágeno tipo III y que solo se vuelven malignas una vez que el nivel de este colágeno disminuye.
Mediante experimentos en modelos de ratón, los investigadores han visto también que al enriquecer el entorno de las células con este colágeno podían obligar a las células a permanecer en un estado inactivo y prevenir la reaparición del tumor. Un hallazgo que, a juicio del científico español, "tiene implicaciones clínicas potenciales y puede conducir a encontrar un biomarcador novedoso para predecir la recurrencia de tumores, así como a una intervención terapéutica para reducir las recaídas locales y distantes".
En otras palabras, puede ayudar a diseñar una estrategia destinada a prevenir el despertar de las células inactivas para prevenir la reactivación del cáncer.
El monstruo dormido
La mayoría de las muertes por cáncer se deben a metástasis, que pueden ocurrir varios años después de la extirpación de un tumor. Investigaciones anteriores han mostrado cómo las células tumorales dispersas salen del letargo; este nuevo trabajo aporta evidencias de cómo las células permanecen inactivas.
“Siempre ha sido complejo de entender por qué un paciente desarrolla un tumor quince o veinte años después de haber quedado limpio por una operación”, explica Bravo-Cordero a Vozpópuli desde su despacho en Nueva York. “Lo que mostramos en este estudio es que las células son capaces de crear un nicho que sostiene esa latencia”.
La mayoría de las muertes por cáncer se deben a metástasis, que pueden ocurrir varios años después de extirpar de un tumor.
Una de las características que hace especial a su laboratorio es que estudian las células tumorales in vivo, lo que les permite observar mejor los procesos que se producen en los tejidos. “Tenemos ratones que tienen tumores, pero en lugar de sacar una muestra, nosotros ponemos el ratón en microscopio”, explica. “Les ponemos una serie de ventanas y los observamos durante meses, con esa manera de observar podemos ver cómo se comportan las células y examinar la arquitectura de la matriz”.
Fue así como encontraron la primera pista que les llevó a tirar del hilo. Al localizar las células tumorales durmientes en los ratones, vieron que la disposición de la matriz de colágeno que tienen en su entorno aparecía una organización diferente de la que tienen esas células cuando el cáncer está proliferando y en plena actividad. "Lo que vimos es que la arquitectura tridimensional es diferente", explica el coautor del estudio, que trabaja como profesor Asociado de Medicina (Hematología y Oncología Médica) en el Instituto del Cáncer Tisch en Mount Sinaí.
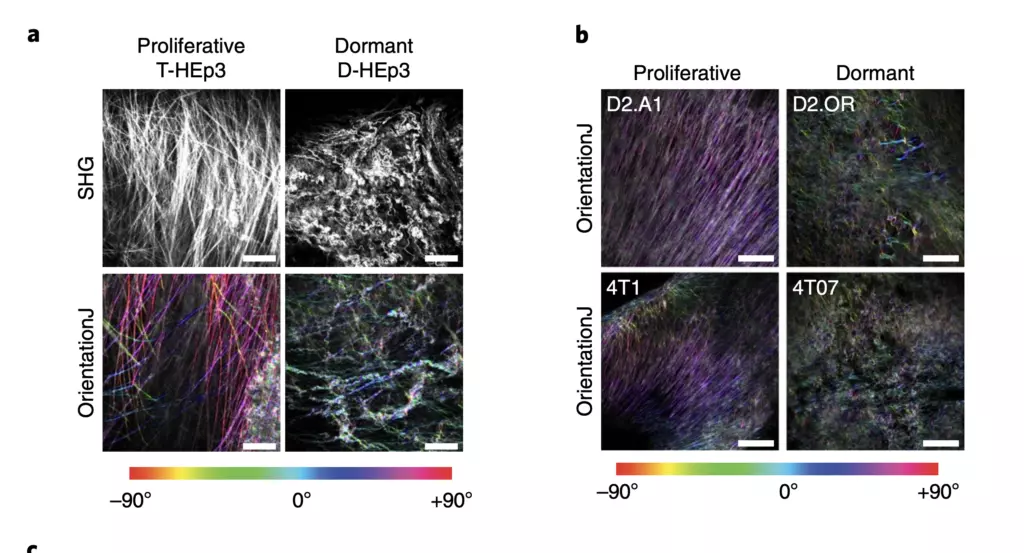
Utilizando técnicas de imagen de alta resolución, incluida la microscopía de dos fotones, los investigadores pudieron rastrear células tumorales inactivas en modelos de ratón utilizando líneas celulares de cáncer de mama y de cabeza y cuello. Y documentaron los cambios en la arquitectura de la matriz extracelular a medida que las células tumorales se volvían inactivas y cómo cambiaba cuando estas células se despertaban. La clave estaba en el tipo de colágeno.
Colágeno contra la metástasis
En muestras de pacientes, los investigadores demostraron que una gran cantidad de colágeno podría usarse como una medida potencial para predecir la recurrencia del tumor y la metástasis. En los modelos de ratón, cuando los científicos aumentaron la cantidad de colágeno tipo III alrededor de las células cancerosas que habían dejado un tumor, se interrumpió la progresión del cáncer y las células diseminadas se vieron obligadas a entrar en un estado latente.
En los modelos de ratón, aumentar el colágeno tipo III interrumpió la progresión del cáncer
“Uno de los experimentos consistió en hacer crecer un tumor en los ratones, hacer una cirugía para quitarlo y en vez de directamente coser y cerrar, lo que hicimos fue tratar esa zona y poner una cama de colágenos III”, explica Bravo-Cordero. “Lo que sucedió fue que en los ratones que estaban tratados con ese colágeno el tumor no regresaba, estas estrategias que puedan tratar la zona quizá puedan prevenir que el tumor reaparezca”.
Esto es algo similar a lo que ya se hace en el tratamiento de heridas, apunta, donde se utilizan armazones de colágeno como una alternativa terapéutica para heridas complejas de la piel. Lo que sugiere este resultado es la posibilidad de enriquecer el microambiente tumoral con colágeno tipo III durante las cirugías de extirpación de los tumores, de modo que se facilite la latencia de las células tumorales y se prevenga la futura metástasis.
"Se trata de entender la biología primero y desarrollar terapias después", asegura Bravo-Cordero.
“Otra posibilidad sería encontrar un fármaco que promoviera niveles altos de colágeno en el tejido donde se cree que se puede desarrollar esa metástasis”, propone Bravo-Cordero, quien reconoce que aún quedan muchas incógnitas por delante, pero se muestra esperanzado. "La biología de las células durmientes nos da una ventana de trabajo muy superior", sentencia. "Se trata de entender la biología primero y desarrollar terapias después".

Un largo camino hacia la terapia
Para el investigador Héctor Peinado, jefe del Grupo de Microambiente y Metástasis del Centro Nacional de Investigaciones Oncológicas (CNIO), se trata de un interesante avance dentro de un campo abierto hace unos años por uno de los coautores del estudio, Julio Aguirre-Ghiso, quien descubrió que las metástasis durmientes ocurren desde los estadíos más tempranos. “Este trabajo la contribución que hace es detectar la molécula, el colágeno de tipo III, que actúa como una señal para que la célula tumoral siga quiescente y tranquilita”, explica a Vozpópuli.
El principal reto, a juicio de este investigador (que no ha participado en este estudio), es conseguir llevar a la clínica esta estrategia para que el cáncer siga siga silente, algo en lo que trabajan varios grupos en todo el mundo. “La dificultad es terapéutica”, asegura. “El concepto interesante es que puedas promover un fenotipo silenciado y convivir con ello”.
Para conseguirlo, no se trata tanto de introducir el colágeno específico en los tejidos, sino de construir los andamios en los que se ancle esta proteína. Como quien coloca postes para que el cáncer construya sus nidos y permanezca en ellos. “Cada tipo tumoral y cada subtipo probablemente tenga un mecanismo en el que vaya a promover esta activación o silenciamiento”, explica, “y cada pasito que demos nos va a conducir a una serie de terapias que se combinan con las que ya existen para reducir aún más la metástasis”.
En resumen, con este nuevo trabajo Bravo-Cordero y su equipo han dado un paso importante para saber dónde “duerme” el cáncer y con qué clase de material fabrica el "nido" en el que hiberna. También se abre una puerta a comprender mejor por qué en unas zonas del cuerpo las células tumorales permanecen en quiescencia y en otras forman metástasis, y si existe relación con las acumulaciones de determinados tipos de colágeno. Pero sobre todo, señalan los propios autores, se abre por primera vez una puerta al diseño de estrategias que conserven las ramas de ese "nido" para que cronifique y el cáncer nunca más vuelva a despertar.
Referencia: A tumor-derived type III collagen-rich ECM niche regulates tumor cell dormancy (Nature Cancer) | DOI 10.1038/s43018-021-00291-9


Ya no se pueden votar ni publicar comentarios en este artículo.