Imagine tener una máquina del tiempo molecular y poder programarla para ver el pasado de una proteína. Imagine también que puede utilizar esa misma máquina para reconstruir los cambios que experimentó la nucleasa Cas9 - el principal componente de la herramienta de edición genética CRISPR - y asomarse a cómo pudo ser su versión más antigua, hace 2.600 millones de años, y su evolución a lo largo del tiempo.
Y ahora imagine que esas primeras herramientas moleculares de las bacterias tienen propiedades prometedoras para la edición genética.
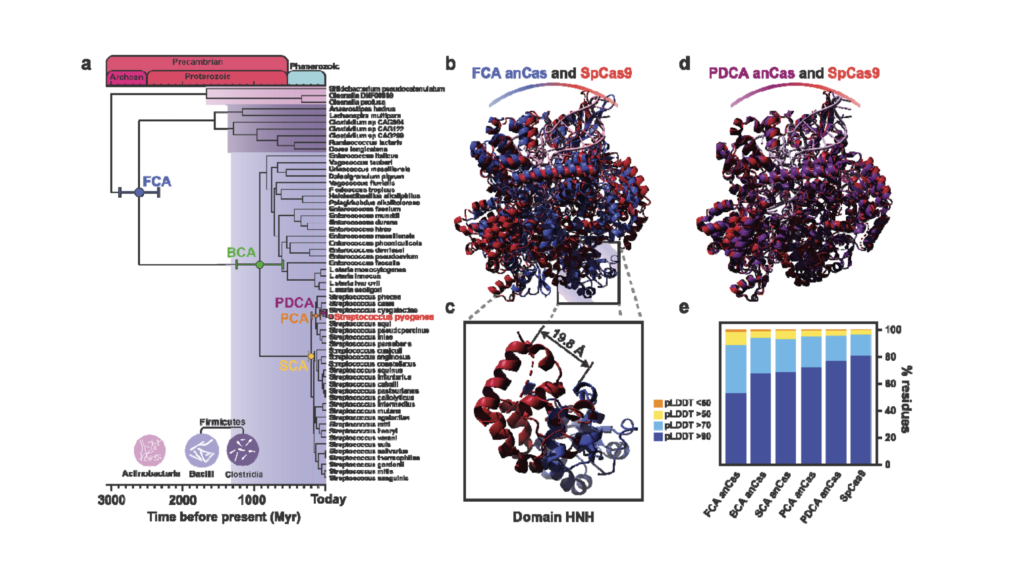
Esto es lo que ha conseguido un equipo de científicos españoles liderados por Raúl Pérez Jiménez, investigador del CIC Nanogune, mediante el uso de técnicas de “Reconstrucción de secuencias ancestrales" (ASR, por sus siglas en inglés). Los autores del trabajo, que debido a su relevancia se publica anticipadamente en Biorxiv a falta de revisión por pares, no solo han reconstruido computacionalmente cinco posibles ancestros de esta proteína que las bacterias usan para defenderse de los virus, sino que las han “resucitado”.
Es decir, después de fabricar esas proteínas conforme al resultado del modelo, las han puesto a funcionar en cultivos de células humanas y - a pesar de que son diferentes y han sufrido multitud de cambios - han visto que no solo cumplen su función de cortar y editar el ADN igual que las Cas9 actuales, sino que son más versátiles de cara a sus posibles aplicaciones. “Lo que nos encontramos es que cuando vamos atrás en el tiempo muchos de estos elementos son muy flexibles”, explica Pérez a Vozpópuli, “y esa flexibilidad los hace especialmente versátiles como herramientas de edición genética, porque no tienen tantas restricciones”.
Un viaje en el tiempo
La historia de este descubrimiento comienza en 2018, cuando Pérez Jiménez - con una larga trayectoria en el campo de la denominada paleoenzimología - decidió utilizar las técnicas de reconstrucción del pasado genético en la herramienta más popular del momento. "El sistema CRISPR/Cas9 era el más famoso y lo sigue siendo, y me di cuenta de que esa proteína era perfecta para aplicar esta técnica, porque es un sistema de defensa adaptativo, es decir, que ha evolucionado, y hay muchas nucleasas, con lo cual se puede reconstruir una familia, con un árbol filogenético”.
El investigador español lleva trabajando en el campo de la reconstrucción de secuencias ancestrales desde 2009 y contaba con las herramientas y el conocimiento para afrontar semejante desafío. “La técnica consiste en utilizar los genes o proteínas de especies que hoy día conocemos y se relacionan entre sí para, utilizando técnicas computacionales, obtener los genes más probables de sus antepasados”. Para entenderlo, el científico suele utilizar la analogía del lenguaje: igual que analizando la raíz de una palabra y sus antecedentes en lengua romance y euroasiática se puede saber de dónde viene, tomando una familia de proteínas se puede retroceder y establecer su origen.
“Las nucleasas más jóvenes que hemos reconstruido datan de la época de los dinosaurios”
“La idea es construir un árbol filogenético que te permita ver cómo han evolucionado unas proteínas a partir de otras”, resume Lluis Montoliu, investigador del CNB-CSIC y coautor del trabajo. “Lo que hacen estos programas informáticos - que requieren mucha potencia de cálculo - es viajar hacia atrás”, añade. “Nosotros hemos reconstruido proteínas Cas de 2600, de 1000, de 200 millones de años y la más joven tiene entre 137 millones y 37 millones de años, de la época de los dinosaurios”.
El inicio de una vieja batalla
Lo primero que produce un resultado como este es una sensación de vértigo, al poder asomarse a un pasado tan remoto de las bacterias y obtener pruebas indirectas de que hace 2.600 millones de años - cuando las procariotas dominaban la vida del planeta en solitario - ya se estaban defendiendo de los virus.
“Esto es como ciencia ficción hecha realidad; viajar en el tiempo, le duele a uno la cabeza solo de pensarlo”, asegura Francis Mojica, investigador de la Universidad de Alicante y descubridor del sistema de defensa de las bacterias CRISPR. “Me contactó Raúl hace unos años y yo, de partida, puse en duda que eso fuera posible, irse tan atrás me parecía demasiado arriesgado”, recuerda. “Pero cuando empezó a mostrarme los primeros resultados me quedé asombrado; cuando ves que evolutivamente la cosa tiene sentido y que el sistema cada vez se va haciendo más especializado… Para mí es un orgullo haber participado”.
“Esto es como ciencia ficción hecha realidad, como viajar en el tiempo”, asegura Francis Mojica
El dato más interesante del estudio, que ha requerido una estrecha colaboración de varios laboratorios, es que permite ver cómo las defensas de las bacterias contra los virus - aquel CRISPR primitivo - se fueron haciendo más complejas a medida que aparecían nuevas amenazas. “Estas nucleasas ancestrales siguen manteniendo los mismos dominios activos que las actuales, pero tienen sus peculiaridades”, asegura Mojica. "Hace miles de millones de años se podían permitir el lujo de tener sistemas más relajados, y luego lo que han hecho es ir evolucionando, porque hay muchos virus intentando atacarlas. Han tenido que ir poniéndose las pilas”.
Para Miguel Ángel Moreno Pelayo, responsable del departamento de Genética del Hospital Ramón y Cajal, que participó en el trabajo comprobando que las nucleasas ancestrales habían hecho efectivamente su trabajo tras ser resucitadas, es como si las bacterias primitivas hubieran empezado a defenderse con hachas y hoy tuvieran un sistema de combate más moderno. “Imagina que estás en en la Edad de Piedra y te atacan con arcos y flechas, no necesitas discriminar mucho”, asegura. “Pero hoy necesitan un mísil teledirigido que discrimine al objetivo”.
Es como si las bacterias primitivas se hubieran defendido con hachas y hoy tuvieran un sistema más moderno.
En términos generales, lo que fueron haciendo estas Cas ancestrales a medida que evolucionaban para defenderse de los virus fue adquirir la capacidad de corte de las dos hebras de ADN y desarrollar un sistema de identificación de patógenos más específico llamado “motivo adyacente de protoespaciador" (un sistema al que el propio Mojica nombró como PAM, por sus siglas en inglés, y que permite a CRISPR anclar los puntos de corte). En las primeras nucleasas que desarrollaron las bacterias para defenderse, estos identificadores no estaban presentes y, por increíble que parezca, 2600 millones de años después la “ingenuidad” de aquellos “abueletes” de las bacterias, como los llama Mojica, puede ser una gran ventaja.
El futuro está en el pasado
Aunque pendiente de revisión, este resultado confirma algo que Pérez Jiménez lleva años defendiendo: que el futuro de la biotecnología puede estar en el pasado. “Más allá de lo filosófico, esto tiene un significado químico y biológico”, sostiene. “Las enzimas pasan un proceso de especialización. Hoy día es necesario que sean capaces de funcionar en condiciones muy diversas y la especialización limita eso. Sin embargo, en las reconstrucciones ancestrales de repente empiezas a ver que hay promiscuidad química, y eso es muy interesante para su aplicación”.
Tener un sistema de edición menos especializado puede permitir llegar a sitios que las Cas9 actuales no permiten
“Hay una persistente búsqueda de nuevos sistemas CRISPR que están en bacterias y arqueas en los sitios más remotos”, añade Montoliu. “Hay biólogos buscando versiones de CRISPR con propiedades distintas en los géiseres, en el Everest, en la fosa de las Marianas… Pero también las puedes buscar retrocediendo en el tiempo, que es lo que hemos hecho nosotros”. Es en este sentido como, paradójicamente, “ir hacia atrás” puede suponer una ventaja. “La ingenuidad que podían tener una nucleasa ancestral, en cuanto a que no reconoce tan específicamente algunas regiones del genoma, puede posibilitar llevar esa maquinaria donde no sean tan dependientes de esas PAM y ganar versatilidad”, apunta Moreno Pelayo.
El equipo de Pérez Jiménez - que no consiguió financiación para estudiar el pasado de las CRISPR - acaba de conseguir fondos para aplicar estos nuevos conocimientos en la investigación de la Esclerosis Lateral Amiotrófica (ELA). “Y la base de este proyecto es usar las Cas ancestrales”, subraya Moreno Pelayo, que también participa en la iniciativa. “Se va a intentar aplicar CRISPR en mutaciones específicas que causan ELA, limitadas porque no tienen una PAM cerca de ellas y es más difícil dirigirlas. Es una prueba de concepto perfecta”.
Y otra demostración de que la investigación básica abre caminos sobre los que ni siquiera nos atrevíamos a soñar antes de emprenderlos.
Referencia: Evolution of CRISPR-associated Endonucleases as Inferred from Resurrected Proteins (Biorxiv)



Ya no se pueden votar ni publicar comentarios en este artículo.